Един от важните въпроси при изучаването на термодинамичните системи във физиката е въпросът дали тази система може да извърши някаква полезна работа. Тясно свързано с понятието работа е понятието вътрешна енергия. В тази статия ще разгледаме каква е вътрешната енергия на идеалния газ и ще дадем формули за нейното изчисляване.
Идеален газ
За газа, като агрегатно състояние, което няма никаква еластична сила при външно въздействие върху него и в резултат на това не запазва обем и форма, всеки ученик знае. Концепцията за идеален газ за мнозина остава неразбираема и неясна. Нека го обясним.
Идеален газ е всеки газ, който отговаря на следните две важни условия:
- Частиците, които го изграждат, нямат размер. Те имат размер, но той е толкова малък в сравнение с разстоянията между тях, че може да бъде игнориран при всички математически изчисления.
- Частиците не взаимодействат помежду си, използвайки сили или сили на Ван дер Ваалсдруга природа. Всъщност във всички реални газове има такова взаимодействие, но енергията му е незначителна в сравнение със средната енергия на кинетичните частици.
Описаните условия отговарят на почти всички реални газове, чиито температури са над 300 K, а наляганията не надвишават една атмосфера. При твърде високи налягания и ниски температури се наблюдава отклонението на газовете от идеалното поведение. В този случай се говори за истински газове. Те се описват с уравнението на Ван дер Ваалс.
Концепцията за вътрешната енергия на идеалния газ
Съгласно дефиницията, вътрешната енергия на системата е сумата от кинетичната и потенциалната енергия, съдържащи се в тази система. Ако тази концепция се приложи към идеален газ, тогава потенциалният компонент трябва да бъде изхвърлен. Всъщност, тъй като частиците на идеалния газ не взаимодействат една с друга, те могат да се считат за свободно движещи се в абсолютен вакуум. За да се извлече една частица от изследваната система, не е необходимо да се работи срещу вътрешните сили на взаимодействие, тъй като тези сили не съществуват.
По този начин вътрешната енергия на идеалния газ винаги съвпада с неговата кинетична енергия. Последното от своя страна се определя уникално от моларната маса на частиците на системата, техния брой, както и средната скорост на транслационно и въртеливо движение. Скоростта на движение зависи от температурата. Повишаването на температурата води до увеличаване на вътрешната енергия и обратно.
Формула завътрешна енергия
Означаваме вътрешната енергия на идеална газова система с буквата U. Според термодинамиката тя се определя като разликата между енталпията H на системата и произведението на налягането и обема, тоест:
U=H - pV.
В параграфа по-горе открихме, че стойността на U съответства на общата кинетична енергия Ekна всички газови частици:
U=Ek.
От статистическата механика, в рамките на молекулярната кинетична теория (MKT) на идеалния газ, следва, че средната кинетична енергия на една частица Ek1 е равна на следната стойност:
Ek1=z/2kBT.
Тук kB и T - Болцманова константа и температура, z - брой степени на свобода. Общата кинетична енергия на системата Ek може да се получи чрез умножаване на Ek1 по броя на частиците N в системата:
Ek=NEk1=z/2NkBT.
Така получихме формулата за вътрешната енергия на идеалния газ, написана в общ вид по отношение на абсолютната температура и броя на частиците в затворена система:
U=z/2NkBT.
Монатомен и многоатомен газ
Формулата за U, написана в предишния параграф на статията, е неудобна за практическото й използване, тъй като е трудно да се определи броят на частиците N. Въпреки това, ако вземем предвид определението за количеството вещество n, тогава този израз може да бъде пренаписан в по-удобна форма:
n=N/NA; R=NAkB=8, 314 J/(molK);
U=z/2nR T.
Броят на степените на свобода z зависи от геометрията на частиците, които изграждат газа. По този начин, за едноатомен газ, z=3, тъй като атомът може да се движи независимо само в три посоки на пространството. Ако газът е двуатомен, тогава z=5, тъй като към трите транслационни степени на свобода се добавят още две ротационни степени на свобода. И накрая, за всеки друг многоатомен газ, z=6 (3 транслационни и 3 ротационни степени на свобода). Имайки предвид това, можем да напишем в следната форма формулите за вътрешната енергия на идеален газ от едноатомен, двуатомен и многоатомен:
U1=3/2nRT;
U2=5/2nRT;
U≧3=3nRT.
Пример за задача за определяне на вътрешна енергия
100-литров цилиндър съдържа чист водород при налягане от 3 атмосфери. Ако приемем, че водородът е идеален газ при дадени условия, е необходимо да се определи каква е неговата вътрешна енергия.

Горните формули за U съдържат количеството вещество и температурата на газа. В условието на проблема за тези количества не се казва абсолютно нищо. За да решим проблема, е необходимо да си припомним универсалното уравнение на Клапейрон-Менделеев. Има вида, показан на фигурата.
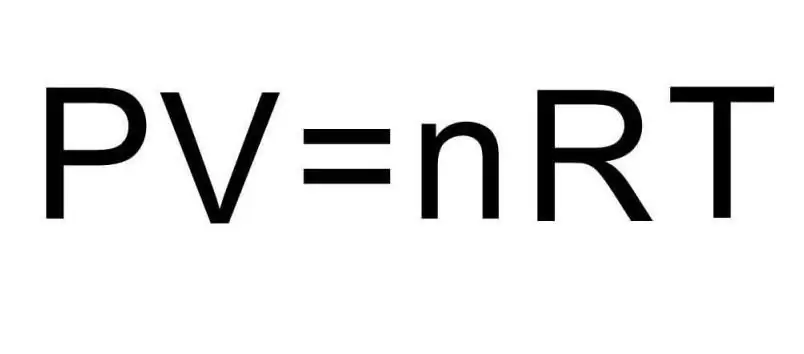
Тъй като водородът H2 е двуатомна молекула, формулата за вътрешна енергия е:
UH2=5/2nRT.
Сравнявайки двата израза, стигаме до крайната формула за решаване на проблема:
UH2=5/2PV.
Остава да преобразувате единиците за налягане и обем от условието в системата от единици SI, замените съответните стойности във формулата за UH2 и получите отговор: UH2 ≈ 76 kJ.






