Адиабатният преход между две състояния в газовете не е един от изопроцесите, но играе важна роля не само в различни технологични процеси, но и в природата. В тази статия ще разгледаме какъв е този процес и ще дадем адиабатните уравнения за идеален газ.
Идеален газ накратко
Идеален газ е този, в който няма взаимодействия между неговите частици и техните размери са равни на нула. В природата, разбира се, няма сто процента идеални газове, тъй като всички те са съставени от молекули и атоми с размер, които винаги взаимодействат помежду си поне с помощта на ван дер Ваалсови сили. Въпреки това описаният модел често се изпълнява с достатъчна точност за решаване на практически задачи за много реални газове.
Основното уравнение на идеалния газ е законът на Клапейрон-Менделеев. Пише се в следната форма:
PV=nRT.
Това уравнение установява пряка пропорционалност между продуктаналягане P върху обема V и количеството вещество n върху абсолютната температура T. Стойността на R е газовата константа, която играе ролята на коефициент на пропорционалност.
Какво е адиабатен процес?
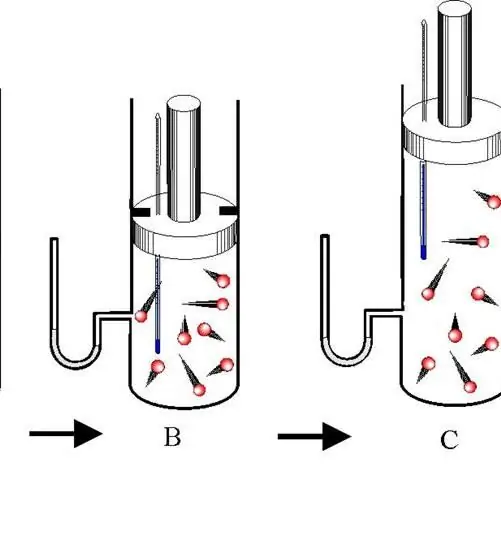
Адиабатният процес е преход между състоянията на газова система, при които няма обмен на енергия с околната среда. В този случай и трите термодинамични характеристики на системата (P, V, T) се променят и количеството вещество n остава постоянно.
Разграничаване между адиабатно разширение и свиване. И двата процеса протичат само благодарение на вътрешната енергия на системата. Така в резултат на разширението налягането и особено температурата на системата намаляват драстично. Обратно, адиабатната компресия води до положителен скок в температурата и налягането.
За да се предотврати топлообменът между околната среда и системата, последната трябва да има топлоизолирани стени. В допълнение, съкращаването на времето на процеса значително намалява топлинния поток към и от системата.
Поасонови уравнения за адиабатен процес

Първият закон на термодинамиката е написан както следва:
Q=ΔU + A.
С други думи, топлината Q, предавана на системата, се използва за извършване на работа A от системата и за увеличаване на нейната вътрешна енергия ΔU. За да се напише адиабатното уравнение, трябва да се постави Q=0, което съответства на определението на изследвания процес. Получаваме:
ΔU=-A.
С изохорнипроцес в идеален газ, цялата топлина отива за увеличаване на вътрешната енергия. Този факт ни позволява да запишем равенството:
ΔU=CVΔT.
Където CV е изохорният топлинен капацитет. Работа А от своя страна се изчислява, както следва:
A=PdV.
Где dV е малка промяна в силата на звука.
В допълнение към уравнението на Клапейрон-Менделеев, за идеален газ важи следното уравнение:
CP- CV=R.
Където CP е изобарният топлинен капацитет, който винаги е по-голям от изохорния, тъй като отчита загубите на газ поради разширяване.
Анализирайки уравненията, написани по-горе и интегрирайки по температура и обем, стигаме до следното адиабатно уравнение:
TVγ-1=const.
Тук γ е адиабатният индекс. То е равно на съотношението на изобарния топлинен капацитет към изохорния. Това равенство се нарича уравнение на Поасон за адиабатен процес. Прилагайки закона Клапейрон-Менделеев, можете да напишете още два подобни израза, само чрез параметрите P-T и P-V:
TPγ/(γ-1)=const;
PVγ=const.
Адиабатната графика може да бъде дадена в различни оси. По-долу е показан в P-V оси.
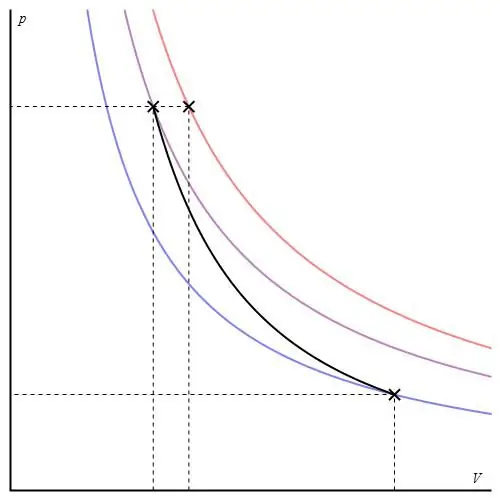
Цветните линии на графиката отговарят на изотерми, черната крива е адиабата. Както се вижда, адиабата се държи по-рязко от която и да е от изотермите. Този факт е лесен за обяснение: за изотермата налягането се променя обратнопропорционално на обема, но за изобата, налягането се променя по-бързо, тъй като експонентът е γ>1 за всяка газова система.
Примерен проблем
В природата, в планинските райони, когато въздушната маса се движи нагоре по склона, налягането й спада, увеличава обема и се охлажда. Този адиабатен процес понижава точката на оросяване и произвежда течни и твърди валежи.

Предлага се да се реши следният проблем: в процеса на издигане на въздушната маса по склона на планината, налягането спадна с 30% в сравнение с налягането в подножието. На каква беше температурата му, ако в подножието беше 25 oC?
За да решите проблема, използвайте следното адиабатно уравнение:
TPγ/(γ-1)=const.
По-добре е да го напишете в тази форма:
T2/T1=(P2/P 1)(γ-1)/γ.
Ако P1 се вземе като 1 атмосфера, тогава P2 ще бъде равно на 0,7 атмосфери. За въздуха адиабатният индекс е 1,4, тъй като може да се счита за двуатомен идеален газ. Стойността на температурата на T1 е 298,15 K. Замествайки всички тези числа в израза по-горе, получаваме T2=269,26 K, което съответства на - 3, 9 oC.






