Алдехидите са органични вещества, свързани с карбонилни съединения, съдържащи функционална група -CH, която се нарича карбонилна група.
В зависимост от естеството на въглеводородния скелет на молекулата, алдехидите са наситени, ненаситени и ароматни. Техните молекули могат също да включват халогенни атоми или допълнителни функционални групи. Общата формула за наситени алдехиди е C H2 O. В съответствие с номенклатурата на IUPAC имената им завършват с наставка -al.
Окислението на алдехидите е важно в индустрията, тъй като те доста лесно се превръщат в карбоксилни киселини. В този случай меден хидроксид, сребърен оксид или дори атмосферен кислород могат да служат като окислители.
Структура на карбонилната група
Електронната структура на двойната връзка в C=O групата се характеризира с образуването на една σ-връзка и още една π-връзка. Атом С е в състояние на sp2-хибридизация, плоска молекула с ъгли на свързване между връзките от около 1200. Разликата между двойната връзка в тази функционална група се състои във факта, че тя се намира между въглеродния атом и силно електроотрицателния кислороден атом. Като резултателектроните се привличат към атома О, което означава, че тази връзка е много силно поляризирана.
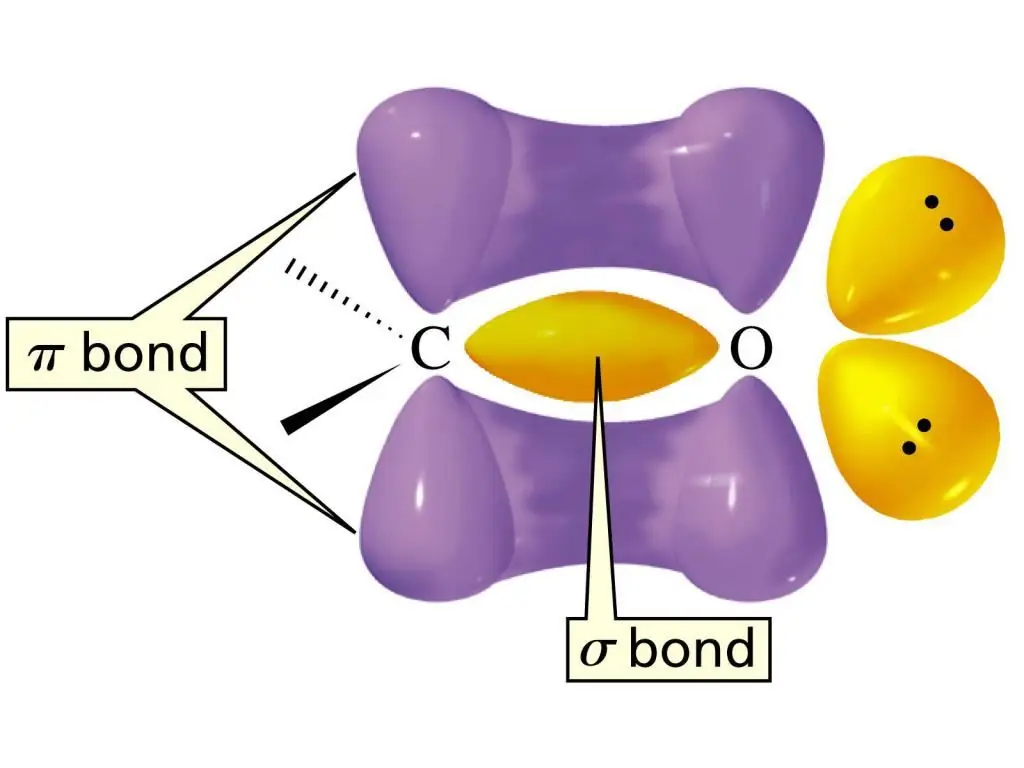
Съдържанието на такава поляризирана двойна връзка в алдехидната група може да се нарече основна причина за високата реактивност на алдехидите. За алдехидите най-характерни са реакциите на присъединяване на атоми или техните групи към връзката С=О. А реакциите на нуклеофилно присъединяване са най-лесни за протичане. Характерни за алдехидите също са реакции, включващи Н атоми от функционалната група на алдехидите. Поради ефекта на изтегляне на електрони на групата C=O, полярността на връзката се увеличава. Това от своя страна е причината за относително лесното окисление на алдехидите.
Някои представители на алдехидите
Формалдехид (формалдехид или метанал) CH2O е газообразно вещество с много остра миризма, което обикновено се получава чрез преминаване на смес от метанолни пари с въздух през червено -гореща мрежа от медна или сребърна мрежа. Неговият 40% воден разтвор се нарича формалин. Формалдехидът лесно влиза в реакции, много от които са в основата на промишления синтез на редица важни вещества. Използва се и за получаване на изопренов каучук, пентаеритритол, много лечебни вещества, различни багрила, за дъбене на кожи, като дезинфектант и дезодорант. Формалдехидът е доста токсичен, неговата ПДК във въздуха е 0,001 mg/l.
Ацеталдехид (оцетен алдехид, етанал) CH3SON е безцветна течност със задушаваща миризма, която при разреждане с вода придобиваплодов аромат. Ацеталдехидът притежава всички основни свойства на алдехидите. Окислението на ацеталдехида произвежда огромни количества оцетна киселина и оцетен анхидрид, различни фармацевтични продукти.
Акролеин (пропенал) CH2=CH-SON, най-простият ненаситен алдехид, е безцветна, летлива течност. Неговите пари силно дразнят лигавиците на очите и горните дихателни пътища. Много отровен, MPC на съдържанието му във въздуха е 0,7 mg/m3. Пропеналът е междинен продукт в синтеза на определени полимери и е необходим при производството на някои лекарства.

Бензалдехид (бензоен алдехид) С6Н5SON е безцветна течност, която пожълтява по време на съхранение с вкус на горчив бадем. Доста бързо се окислява от въздуха до бензоена киселина. Съдържа се в етеричните масла от растения (нероли, пачули), а под формата на глюкозид - в ядките на горчивите бадеми, черешите, кайсиите и прасковите. Като ароматна субстанция се използва в парфюмерията, като компонент на хранителните есенции, като суровина за синтеза на други ароматни вещества (канелен дехид, жасминалдехид).
Реакция на сребърно огледало
Окислението на алдехидите със сребърен оксид е най-значимата качествена реакция към съответната форма на функционалната група. Тази реакция получи името си поради тънкото сребърно покритие по стените на епруветката, което се образува по време на тази реакция.
Неговата същност се крие във взаимодействието на алдехид R-COH с амонячен разтвор на оксидсребро(I), което е разтворимо комплексно съединение [Ag(NH3)2]OH и се нарича реагент на Толенс. Реакцията се провежда при температури, близки до точката на кипене на водата (80-100 °C). В този случай алдехидите се окисляват до съответните им карбоксилни киселини, а окислителят се редуцира до метално сребро, което се утаява.
Подготовка на реагенти
За качественото определяне на групата -SON в алдехидите първо се приготвя сребърно комплексно съединение. За да направите това, малко разтвор на амоняк (амониев хидроксид) във вода се излива в епруветка, последвано от малко количество сребърен нитрат. В този случай получената утайка от сребърен оксид незабавно изчезва:
2AgNO3 + 2NH3 + H2O -> Ag 2O↓ + 2NH4NO3
Ag2O + 4NΗ3 + Η2O -> 2[Ag (NΗ3)2]ОΗ
По-надеждни резултати дава реагентът на Толенс, приготвен с алкали. За да направите това, 1 g AgNO3 се разтваря в 10 g дестилирана вода и се добавя равен обем концентриран натриев хидроксид. В резултат на това се утаява утайка от Ag2O, която изчезва, когато се добави концентриран разтвор на амониев хидроксид. За реакцията трябва да се използва само прясно приготвен реагент.

Механизъм за реакция
Реакцията на сребърното огледало съответства на уравнението:
2[Ag(NΗ3)2]OΗ + НСОΗ-> 2Ag↓ + ΗCOONΗ4 + 3NΗ3 + H2O
Заслужава да се отбележи, че за алдехидите това взаимодействие не е достатъчно проучено. Механизмът на тази реакция е неизвестен, но се предполага радикално или йонно окисление. Хидроксидът на диаминсреброто най-вероятно се прибавя с образуването на сребърната сол на диола, от която след това среброто се отцепва, за да се образува карбоксилна киселина.
Чистотата на използваните прибори е изключително важна за успешния експеримент. Това се дължи на факта, че образуваните по време на експеримента колоидни сребърни частици трябва да се придържат към стъклената повърхност, създавайки огледална повърхност. При най-малкото замърсяване той ще се утаи като сива флокулентна утайка.
За почистване на контейнера трябва да се използват алкални разтвори. Така че, за тези цели можете да вземете разтвор на NaOH, който трябва да се измие с голям обем дестилирана вода. Стъклената повърхност трябва да е без мазнини и механични частици.
Окисление с меден хидроксид
Реакцията на окисляване на алдехиди с меден (II) хидроксид също е доста ефективна и ефективна при определяне на вида на функционалната група. Протича при температура, съответстваща на кипенето на реакционната смес. В същото време алдехидите редуцират двувалентната мед в реактива на Фелинг (прясно приготвен амонячен разтвор на Cu(OH)2) до едновалентна мед. Самите те се окисляват поради въвеждането на кислороден атом в C-H връзката (степента на окисление на C се променя от +1 до +3).
Визуално зад ходареакциите могат да бъдат проследени чрез промяна на цвета на сместа от разтвори. Синкавата утайка от меден хидроксид постепенно става жълта, съответстваща на едновалентен меден хидроксид и по-нататъшната поява на яркочервена утайка Cu2O.
Този процес съответства на уравнението на реакцията:
R-SLEEP + Cu2+ + NaOH + H2O -> R-COONa + Cu 2O + 4H+

Действие с реагент на Джоунс
Заслужава да се отбележи, че такъв реагент действа по най-добрия начин върху алдехидите. В този случай окисляването не изисква нагряване и се извършва при температура 0-20 °C за доста кратък период от време, а добивът на продуктите е повече от 80%. Основният недостатък на реактива на Джоунс е липсата на висока селективност за други функционални групи, а освен това киселата среда понякога води до изомеризация или разрушаване.
Реактивът на Джоунс е разтвор на хромов (VI) оксид в разредена сярна киселина и ацетон. Може да се получи и от натриев дихромат. Когато алдехидите се окисляват, под действието на този реагент се образуват карбоксилни киселини.
Индустриално кислородно окисление
Окислението на ацеталдехида в промишлеността се осъществява чрез действието на кислород в присъствието на катализатори - кобалтови или манганови йони. Първо се образува пероцетната киселина:
CH3-SLEEP + O2 -> CH3-UNOH
Тя от своя страна взаимодейства с втората молекула ацеталдехид и чрез пероксидсъединението дава две молекули оцетна киселина:
CH3-COOH + CH3-SON -> 2CH3-COOH
Окислението се извършва при температура 60-70 °C и налягане от 2 105 Pa.
Взаимодействие с йоден разтвор
За окисляването на алдехидни групи понякога се използва йоден разтвор в присъствието на алкали. Този реагент е от особено значение в процеса на окисление на въглехидратите, тъй като действа много избирателно. Така под негово влияние D-глюкозата се превръща в D-глюконова киселина.
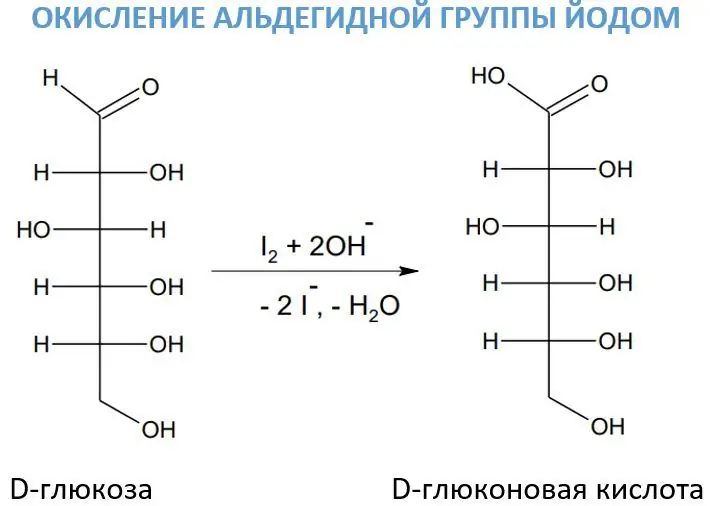
Йодът в присъствието на основи образува хипойодид (много силен окислител):.
Под действието на хипойодид формалдехидът се превръща в метанова киселина: ΗСОΗ + NaIO + NaOΗ -> ΗCOONa + NaI + H2O.
Окислението на алдехиди с йод се използва в аналитичната химия за определяне на тяхното количествено съдържание в разтвори.
Окисление със селенов диоксид
За разлика от предишните реагенти, под действието на селеновия диоксид алдехидите се превръщат в дикарбонилни съединения, а глиоксалът се образува от формалдехид. Ако метиленови или метилови групи са разположени до карбонила, тогава те могат да се превърнат в карбонил. Като разтворител за SeO2 обикновено се използват диоксан, етанол или ксилен.
Съгласно един метод, реакцията се провежда в тригърлена колба, свързана с бъркалка, термометър и обратен хладник. Към изходното вещество, взето в количество от 0,25 mol, се добавя разтвор на капки0,25 mol селенов диоксид в 180 ml диоксан, както и 12 ml H2O. Температурата не трябва да надвишава 20 °C (ако е необходимо, охладете колбата). След това при непрекъснато разбъркване разтворът се вари 6 часа. След това горещият разтвор се филтрува за отделяне на селена и утайката се промива с диоксан. След вакуумна дестилация на разтворителя, остатъкът се фракционира. Основната фракция се взема в широк температурен диапазон (20-30 °C) и се ректифицира.
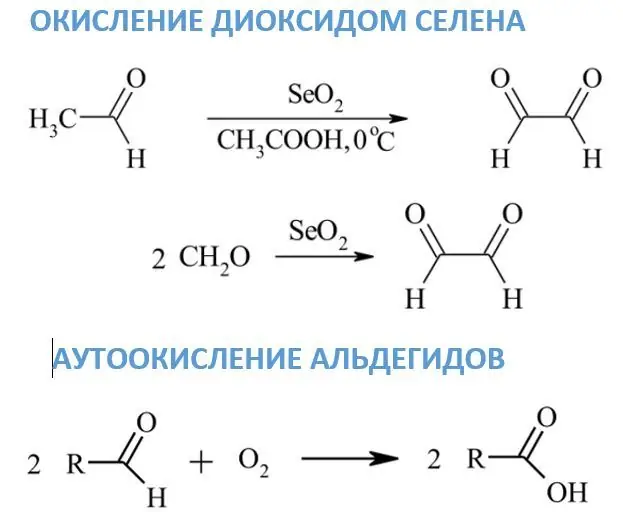
Автоокисление на алдехиди
Под действието на атмосферния кислород при стайна температура, окисляването на алдехидите протича много бавно. Основните продукти на тези реакции са съответните карбоксилни киселини. Механизмът на автоокисляване е свързан с индустриалното окисление на етанал до оцетна киселина. Един от междинните продукти е перкиселина, която реагира с друга алдехидна молекула.
Поради факта, че този тип реакция се ускорява от светлина, пероксиди и следи от тежки метали, може да се заключи, че нейният радикален механизъм. Формалдехидът във водните разтвори се окислява от въздуха много по-лошо от неговите аналози, поради факта, че съществува в тях под формата на хидратиран метилен гликол.

Окисление на алдехиди с калиев перманганат
Тази реакция е най-успешна в кисела среда. Можете да оцените визуално преминаването му по загубата на интензитет и пълното обезцветяване на розовия цвят на разтвора на калиев перманганат. Реакцията протича пристайна температура и нормално налягане, така че не изисква специални условия. Достатъчно е в епруветка да се излеят 2 ml формалдехид и 1 ml разтвор на калиев перманганат, подкиселен със сярна киселина. Разклатете внимателно епруветката с разтвора, за да смесите реагентите:
5CH3-SLEEP + 2KMnO4 + 3H2SO 4 =5CH3-COOH + 2MnSO4 + K2SO 4 + 3H2O
Ако същата реакция се проведе при повишени температури, тогава метаналът лесно се окислява до въглероден диоксид:
5CH3-SLEEP + 4KMnO4 + 6H2SO 4 =5SO2 + 4MnSO4 + 2K2SO 4 + 11Н2O






