Изучаването на процесите, протичащи в статистическите системи, е сложно от минималния размер на частиците и техния огромен брой. Практически е невъзможно да се разгледа всяка частица поотделно, следователно се въвеждат статистически величини: средната скорост на частиците, тяхната концентрация, маса на частиците. Формулата, която характеризира състоянието на системата, като се вземат предвид микроскопичните параметри, се нарича основно уравнение на молекулярно-кинетичната теория на газовете (MKT).
Малко за средната скорост на частиците
Определянето на скоростта на частиците за първи път е извършено експериментално. Добре известен експеримент от училищната програма, проведен от Ото Стърн, направи възможно да се създаде представа за скоростите на частиците. По време на експеримента беше изследвано движението на сребърните атоми във въртящи се цилиндри: първо, в неподвижно състояние на инсталацията, след това, когато тя се върти с определена ъглова скорост.
В резултат на това беше установено, че скоростта на сребърните молекули надвишава скоростта на звука и е 500 m/s. Фактът е доста интересен, тъй като е трудно за човек да усети такива скорости на движение на частиците в веществата.
Идеален газ
Продължете проучванетоИзглежда възможно само в система, чиито параметри могат да бъдат определени чрез директни измервания с помощта на физически инструменти. Скоростта се измерва със скоростомер, но идеята за прикрепване на скоростомер към една частица е абсурдна. Само макроскопичен параметър, свързан с движението на частиците, може да бъде директно измерен.
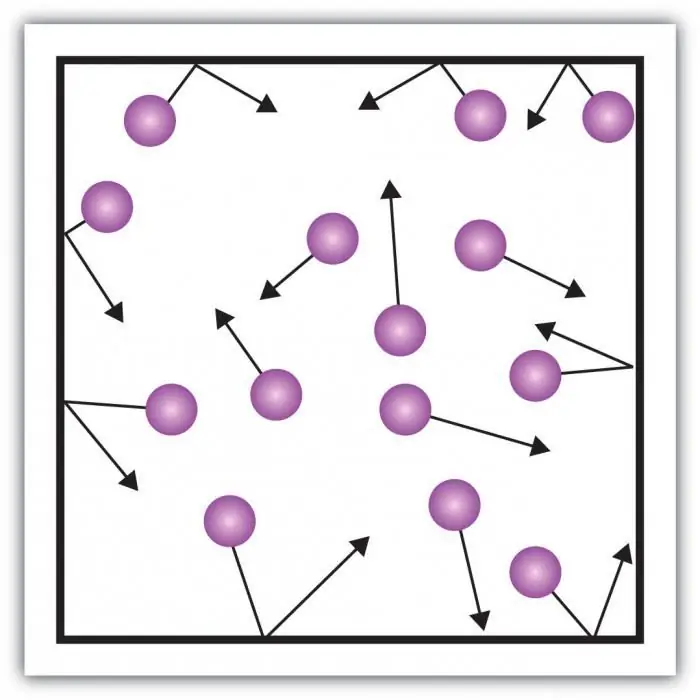
Помислете за налягането на газа. Налягането върху стените на съда се създава от ударите на молекулите на газа в съда. Особеността на газообразното състояние на материята е в достатъчно големи разстояния между частиците и тяхното малко взаимодействие помежду си. Това ви позволява директно да измервате неговото налягане.
Всяка система от взаимодействащи тела се характеризира с потенциална енергия и кинетична енергия на движение. Истинският газ е сложна система. Променливостта на потенциалната енергия не подлежи на систематизиране. Проблемът може да бъде решен чрез въвеждане на модел, който носи характерните свойства на газа, като се отстранява сложността на взаимодействието.
Идеалният газ е състояние на материята, при което взаимодействието на частиците е незначително, потенциалната енергия на взаимодействие клони към нула. Само енергията на движение, която зависи от скоростта на частиците, може да се счита за значима.
Идеално налягане на газа
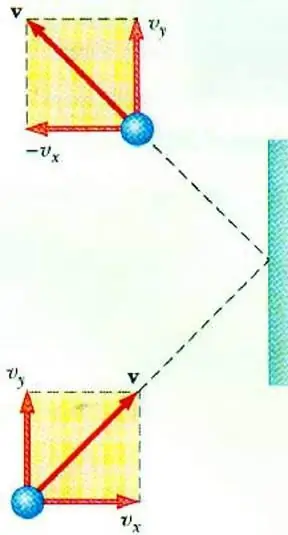
Разкриването на връзката между налягането на газа и скоростта на неговите частици позволява основното уравнение на MKT на идеалния газ. Частица, движеща се в съд, при удар в стената му предава импулс, чиято стойност може да се определи въз основа на втория законНютон:
F∆t=2m0vx
Промяната в импулса на частица по време на еластичен удар е свързана с промяна в хоризонталната компонента на нейната скорост. F е силата, действаща от страната на частицата върху стената за кратко време t; m0 - маса на частиците.
Всички газови частици се сблъскват с повърхността на площ S за времето ∆t, движейки се в посока на повърхността със скорост vx и се намират в цилиндър с обем Sυ x Δt. При концентрация на частици n, точно половината от молекулите се движат към стената, другата половина се движи в обратна посока.
Като разгледахме сблъсъка на всички частици, можем да напишем закона на Нютон за силата, действаща върху площта:
F∆t=nm0vx2S∆t
Тъй като налягането на газа се дефинира като съотношението на силата, действаща перпендикулярно на повърхността, към площта на последната, можем да запишем:
p=F: S=nm0vx2
Резултантната връзка като основно уравнение на MKT не може да опише цялата система, тъй като се разглежда само една посока на движение.
разпределение на Максуел
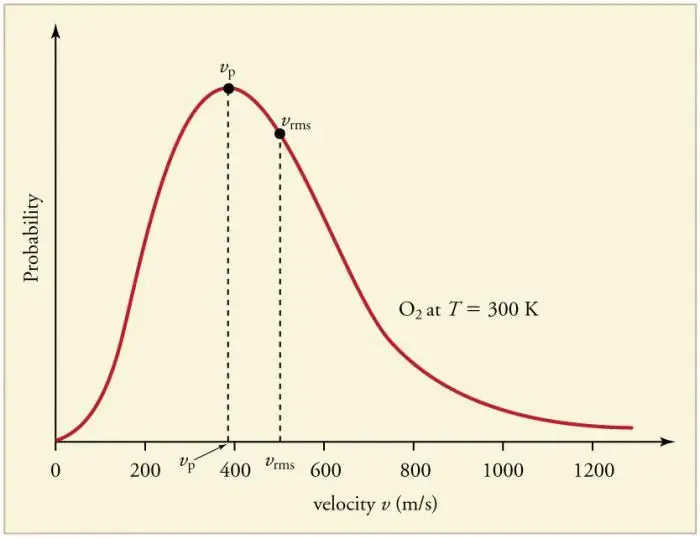
Непрекъснатите чести сблъсъци на газови частици със стените и помежду си водят до установяване на определено статистическо разпределение на частиците по отношение на скоростите (енергии). Посоките на всички вектори на скоростта се оказват еднакво вероятни. Това разпределение се нарича разпределение на Максуел. През 1860 г. този модел е билизвлечено от Дж. Максуел на базата на MKT. Основните параметри на закона за разпределението се наричат скорости: вероятна, съответстваща на максималната стойност на кривата, и средноквадратична vkv=√‹v2 › - средният квадрат на скоростта на частиците.
Увеличаването на температурата на газа съответства на увеличаване на скоростта.
Въз основа на факта, че всички скорости са равни и техните модули имат една и съща стойност, можем да приемем:
‹v2›=‹vx2› + ‹v y2› + ‹vz2›, от: ‹ vx2›=‹v2›: 3
Основното уравнение на MKT, като се вземе предвид средната стойност на налягането на газа, е:
p=nm0‹v2›: 3.
Тази връзка е уникална с това, че определя връзката между микроскопичните параметри: скорост, маса на частиците, концентрация на частици и налягане на газа като цяло.
Използвайки концепцията за кинетичната енергия на частиците, основното уравнение на MKT може да бъде пренаписано по различен начин:
p=2nm0‹v2›: 6=2n‹Ek›: 3
Налягането на газа е пропорционално на средната стойност на кинетичната енергия на неговите частици.
Температура
Интересно е, че за постоянно количество газ в затворен съд може да се свърже налягането на газа и средната стойност на енергията на движението на частиците. В този случай налягането може да се измери чрез измерване на енергиятачастици.
Какво да правя? Каква стойност може да се сравни с кинетичната енергия? Температурата се оказва такава стойност.

Температурата е мярка за топлинното състояние на веществата. За измерването му се използва термометър, чиято основа е термичното разширение на работния флуид (алкохол, живак) при нагряване. Скалата на термометъра е създадена експериментално. Обикновено върху него се поставят маркировки, съответстващи на позицията на работния флуид по време на някакъв физически процес, протичащ при постоянно топлинно състояние (вряща вода, топящ се лед). Различните термометри имат различни скали. Например, Целзий, Фаренхайт.

Универсална температурна скала
Газовите термометри могат да се считат за по-интересни от гледна точка на независимост от свойствата на работния флуид. Техният мащаб не зависи от вида на използвания газ. В такова устройство може хипотетично да се отдели температурата, при която налягането на газа клони към нула. Изчисленията показват, че тази стойност съответства на -273,15 oC. Температурната скала (скала за абсолютна температура или скала на Келвин) е въведена през 1848 г. Възможната температура на нулево налягане на газа беше взета за основна точка на тази скала. Единичен сегмент от скалата е равен на единична стойност на скалата на Целзий. Изглежда по-удобно да се запише основното уравнение на MKT, като се използва температура, когато се изучават газови процеси.
Връзка между налягане и температура
Емпирично можете да потвърдите товапропорционалност на налягането на газа спрямо неговата температура. В същото време беше установено, че налягането е право пропорционално на концентрацията на частиците:
P=nkT,
където T е абсолютна температура, k е константа, равна на 1,38•10-23J/K.
Основната стойност, която има постоянна стойност за всички газове, се нарича константа на Болцман.
Сравнявайки зависимостта на налягането от температурата и основното уравнение на газовете MKT, можем да запишем:
‹Ek›=3kT: 2
Средната стойност на кинетичната енергия на движението на газовите молекули е пропорционална на неговата температура. Тоест температурата може да служи като мярка за кинетичната енергия на движението на частиците.






