При изследване на поведението на газовете във физиката се обръща голямо внимание на изопроцесите, тоест на такива преходи между състоянията на системата, при които се запазва един термодинамичен параметър. Има обаче газов преход между състояния, който не е изопроцес, но играе важна роля в природата и технологиите. Това е адиабатен процес. В тази статия ще го разгледаме по-подробно, като се фокусираме върху това какво е газовата адиабатична експонента.
Адиабатен процес
Съгласно термодинамичната дефиниция под адиабатен процес се разбира такъв преход между началното и крайното състояние на системата, в резултат на което няма топлообмен между външната среда и изследваната система. Такъв процес е възможен при следните две условия:
- топлопроводимост между външната среда исистемата е ниска по една или друга причина;
- скоростта на процеса е висока, така че топлообменът няма време да се случи.
В инженерството адиабатният преход се използва както за загряване на газа по време на рязкото му компресиране, така и за охлаждането му при бързо разширяване. В природата въпросният термодинамичен преход се проявява, когато въздушна маса се издига или пада надолу по склона. Такива възходи и спадове водят до промяна на точката на оросяване във въздуха и валежите.
Уравнение на Поасон за адиабатния идеален газ

Идеалният газ е система, в която частиците се движат произволно с високи скорости, не взаимодействат една с друга и са безразмерни. Такъв модел е много прост по отношение на математическото си описание.
Съгласно дефиницията за адиабатен процес, следният израз може да бъде написан в съответствие с първия закон на термодинамиката:
dU=-PdV.
С други думи, газ, разширяващ се или свиващ се, работи PdV поради съответната промяна във вътрешната му енергия dU.
В случай на идеален газ, ако използваме уравнението на състоянието (законът на Клапейрон-Менделеев), можем да получим следния израз:
PVγ=const.
Това равенство се нарича уравнение на Поасон. Хората, които са запознати с физиката на газа, ще забележат, че ако стойността на γ е равна на 1, тогава уравнението на Поасон ще влезе в закона на Бойл-Мариот (изотермиченпроцес). Такова преобразуване на уравненията обаче е невъзможно, тъй като γ за всеки тип идеален газ е по-голямо от единица. Величината γ (гама) се нарича адиабатичен индекс на идеален газ. Нека разгледаме по-отблизо физическото му значение.
Каква е адиабатната степен?
Показателят γ, който се появява в уравнението на Поасон за идеален газ, е съотношението на топлинния капацитет при постоянно налягане към същата стойност, но вече при постоянен обем. Във физиката топлинният капацитет е количеството топлина, което трябва да бъде прехвърлено или взето от дадена система, за да може тя да промени температурата си с 1 Келвин. Ще обозначим изобарния топлинен капацитет със символа CP, а изохорния топлинен капацитет със символа CV. Тогава равенството е валидно за γ:
γ=CP/CV.
Тъй като γ винаги е по-голямо от единица, това показва колко пъти изобарният топлинен капацитет на изследваната газова система превишава подобна изохорна характеристика.
Топлинен капацитет на CP и CV
За да се определи адиабатният експонент, човек трябва да има добро разбиране на значението на величините CP и CV. За да направим това, ще проведем следния мисловен експеримент: представете си, че газът е в затворена система в съд с плътни стени. Ако съдът се нагрява, тогава цялата предавана топлина в идеалния случай ще се преобразува във вътрешната енергия на газа. В такава ситуация равенството ще бъде валидно:
dU=CVdT.
СтойностCVдефинира количеството топлина, което трябва да бъде прехвърлено към системата, за да се нагрее изохорично с 1 K.
Сега да предположим, че газът е в съд с движещо се бутало. В процеса на нагряване на такава система буталото ще се движи, като се гарантира, че се поддържа постоянно налягане. Тъй като енталпията на системата в този случай ще бъде равна на произведението на изобарния топлинен капацитет и промяната в температурата, първият закон на термодинамиката ще приеме формата:
CPdT=CVdT + PdV.
От тук се вижда, че CP>CV, тъй като в случай на изобарна промяна на състоянията е необходимо изразходват топлина не само за повишаване на температурата на системата, а оттам и нейната вътрешна енергия, но и работата, извършена от газа по време на неговото разширяване.
Стойността на γ за идеален едноатомен газ
Най-простата газова система е едноатомен идеален газ. Да предположим, че имаме 1 мол такъв газ. Припомнете си, че в процеса на изобарно нагряване на 1 mol газ само с 1 Келвин, той наистина работи равен на R. Този символ обикновено се използва за обозначаване на универсалната газова константа. Той е равен на 8, 314 J / (molK). Прилагайки последния израз в предишния параграф за този случай, получаваме следното равенство:
CP=CV+ R.
Откъде можете да определите стойността на изохорния топлинен капацитет CV:
γ=CP/CV;
CV=R/(γ-1).
Известно е, че за една бенкаедноатомен газ, стойността на изохорния топлинен капацитет е:
CV=3/2R.
От последните две равенства следва стойността на адиабатната степен:
3/2R=R/(γ-1)=>
γ=5/3 ≈ 1, 67.
Забележете, че стойността на γ зависи единствено от вътрешните свойства на самия газ (от многоатомната природа на неговите молекули) и не зависи от количеството вещество в системата.
Зависимост на γ от броя на степените на свобода
Уравнението за изохорния топлинен капацитет на едноатомен газ беше написано по-горе. Коефициентът 3/2, който се появи в него, е свързан с броя на степените на свобода в един атом. Той има способността да се движи само в една от трите посоки на пространството, тоест има само транслационни степени на свобода.
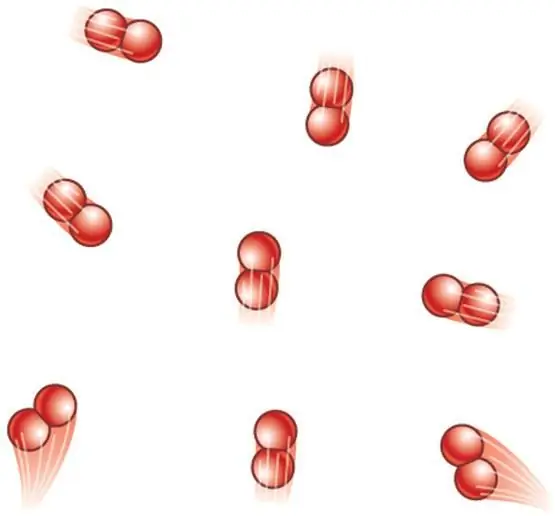
Ако системата е образувана от двуатомни молекули, тогава към трите транслационни степени се добавят още две ротационни степени. Следователно изразът за CV става:
CV=5/2R.
Тогава стойността на γ ще бъде:
γ=7/5=1, 4.
Забележете, че двуатомната молекула всъщност има още една вибрационна степен на свобода, но при температури от няколкостотин келвина тя не се активира и не допринася за топлинния капацитет.
Ако молекулите на газа се състоят от повече от два атома, тогава те ще имат 6 степени на свобода. Адиабатният експонент в този случай ще бъде равен на:
γ=4/3 ≈ 1, 33.
И такаПо този начин, с увеличаване на броя на атомите в газовата молекула, стойността на γ намалява. Ако построите адиабатна графика в осите P-V, ще забележите, че кривата за едноатомен газ ще се държи по-рязко, отколкото за многоатомен.
Адиабатен показател за смес от газове
По-горе показахме, че стойността на γ не зависи от химичния състав на газовата система. Това обаче зависи от броя на атомите, които съставляват неговите молекули. Да приемем, че системата се състои от N компонента. Атомната фракция на компонент i в сместа е ai. След това, за да определите адиабатната степен на сместа, можете да използвате следния израз:
γ=∑i=1N(aiγ i).
Където γi е γ стойността за i-тия компонент.
Например, този израз може да се използва за определяне на γ на въздуха. Тъй като се състои от 99% двуатомни молекули кислород и азот, неговият адиабатичен индекс трябва да бъде много близък до стойността от 1,4, което се потвърждава от експерименталното определяне на тази стойност.






